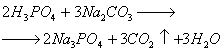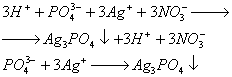Fosforul în corpul uman. Fosforul și compușii săi
Fosforul și compușii săi
Eseul de examen la chimie a fost finalizat de Olya Butochkina, o elevă de clasa a 9-a „d”
Școala secundară Razvilkovskaya cu studiu aprofundat al subiectelor individuale
Moscova, 2002
Introducere
A cincea grupă a sistemului periodic include două elemente tipice azot și fosfor - și subgrupuri de arsen și vanadiu. Există o diferență semnificativă de proprietăți între primul și al doilea element tipic.
În starea substanțelor simple, azotul este un gaz, iar fosforul este un solid. Aceste două substanțe au primit o gamă largă de aplicații, deși atunci când azotul a fost izolat pentru prima dată din aer a fost considerat un gaz dăunător și s-au făcut mulți bani din vânzarea fosforului (fosforul a fost apreciat pentru capacitatea sa de a străluci în întuneric. ).
Istoria descoperirii fosforului
În mod ironic, fosforul a fost descoperit de mai multe ori. Și de fiecare dată când au primit-o din... urină. Există referințe că alchimistul arab Alhild Behil ( XII secolul) a descoperit fosforul în timpul distilării urinei amestecat cu argilă, var și cărbune. Cu toate acestea, data descoperirii fosforului este considerată a fi 1669. Alchimistul amator din Hamburg Henning Brand, un comerciant în faliment care visa să-și îmbunătățească afacerile cu ajutorul alchimiei, a procesat o mare varietate de produse. Presupunând că produsele fiziologice ar putea conține „materia primordială” considerată a fi baza Pietrei Filosofale, Brand a devenit interesat de urina umană.
A colectat aproximativ o tonă de urină din barăcile soldaților și a evaporat-o într-un lichid siropos. Acest lichid a distilat din nou și a obținut un „ulei urinar” roșu greu, care a fost distilat pentru a forma un reziduu solid. Încălzind pe acesta din urmă, fără acces la aer, a observat formarea de fum alb, care s-a așezat pe pereții vasului și a strălucit puternic în întuneric. Marca numită substanța pe care a primit-o fosfor, care în greacă înseamnă „purtător de lumină”.
Timp de câțiva ani, „rețeta de preparare” pentru fosfor a fost păstrată în cea mai strictă încredere și a fost cunoscută doar de câțiva alchimiști. Fosforul a fost descoperit pentru a treia oară de R. Boyle în 1680.
Într-o formă ușor modificată, a fost folosită și vechea metodă de obținere a fosforului XVIII secole: un amestec de urină cu oxid de plumb ( PbO ), sare de masă ( NaCl), potasiu (K2CO3) și cărbune (C ). Abia în 1777, K.V. Scheele a dezvoltat o metodă de obținere a fosforului din coarne și oase de animale.
Compuși naturali și obținerea fosforului
În ceea ce privește prevalența în scoarța terestră, fosforul este înaintea azotului, sulfului și clorului. Spre deosebire de azot, fosforul, datorită activității sale chimice ridicate, apare în natură numai sub formă de compuși. Cele mai importante minerale ale fosforului sunt apatita Ca5X (PO4) 3 (X este fluor, mai rar clor și o grupare hidroxid) și fosforitul, a cărui bază este Ca3 (PO4) 2. Cel mai mare zăcământ de apatită este situat în Peninsula Kola, în regiunea Munților Khibiny. Zăcămintele de fosforit sunt situate în regiunea munților Karatau, la Moscova, Kaluga, regiunile Bryansk si in alte locuri. Fosforul face parte din unele substanțe proteice conținute în organele generatoare ale plantelor, în țesuturile nervoase și osoase ale organismelor animale și umane. Celulele creierului sunt deosebit de bogate în fosfor.
Astăzi, fosforul este produs în cuptoarele electrice prin reducerea apatitei cu cărbune în prezența siliciului:
Ca3(PO4)2+3SiO2+5C® 3CaSiO3+5CO +P2.
Vaporii de fosfor la această temperatură sunt formați aproape în întregime din molecule P2, care, la răcire, se condensează în molecule P4.
Proprietăți chimice
Configurația electronică a atomului de fosfor
1 S 22 S 22 P 63 S 23 P 33 d 0
Stratul exterior de electroni conține 5 electroni. Prezența a trei electroni nepereche în nivelul de energie exterior explică faptul că într-o stare normală, neexcitată, valența fosforului este 3.
Dar la al treilea nivel energetic există celule libere d -orbitali, prin urmare, la trecerea la o stare excitată 3 S -electronii vor fi separați, mergeți la d subnivel, ceea ce duce la formarea a 5 elemente nepereche.
Astfel, valența fosforului în starea excitată este 5.
În compuși, fosforul prezintă de obicei o stare de oxidare de +5, mai rar +3, -3.
1. Reacții cu oxigenul:
4P0 + 5O2 2P2+5O5
(cu lipsă de oxigen: 4P0 + 3O2 2P2+3O3)
2. Cu halogeni și sulf:
2P0 + 3CI2® 2P+3CI3
P0+5S P2+5S5
(Halogenurile de fosfor se descompun ușor de apă, de exemplu:
PCl3 + 3H2O® H3PO3 + 3HCI
PCl5 + 4H2O® H3PO4 + 5HCl)
3. Cu acid azotic:
3P0 + 5HN+5O3 + 2H2O ® 3H3P+5O4 + 5N+2O
4. Formează fosfuri cu metalele, în care fosforul prezintă o stare de oxidare de 3:
2P0 + 3Mg® Mg3P2-3
(fosfura de magneziu se descompune ușor de apă Mg3P2 + 6H2O® 3Mg(OH)2 + 2PH3 (fosfină))
3Li + P® Li3P-3
5. Cu alcali:
4P + 3NaOH + 3H2O® PH3 + 3NaH2PO2
În reacțiile (1,2,3) - fosforul acționează ca agent reducător, în reacția (4) - ca agent de oxidare; reacția (5) este un exemplu de reacție de disproporționare.
Fosforul poate fi atât un agent reducător, cât și un agent oxidant.
Modificări alotropice
În stare liberă, fosforul formează mai multe modificări alotropice. Acest lucru se explică prin faptul că atomii de fosfor sunt capabili să se conecteze reciproc pentru a forma rețele cristaline de diferite tipuri.
tabelul 1
Proprietățile fizice ale fosforului
|
Modificare alotropică |
Densitate, g/cm3 |
t pl, |
balot T, |
|
|
alb |
1,73 |
44,1 |
280,5 |
Pulbere cristalină albă, otrăvitoare, se aprinde spontan în aer. La 280-300°C se transformă în roșu |
|
roșu |
Se sublimeaza la aproximativ 400°C |
Pulbere roșie cristalină sau amorfă, netoxică. La 220°C și 12× 108 Pa se transformă în fosfor negru. Iluminează în aer numai atunci când este aprins |
||
|
Negru |
Când este încălzit, se transformă în fosfor roșu |
Structură asemănătoare grafitului. În condiții normale - un semiconductor, conduce electricitatea sub presiune ca un metal |
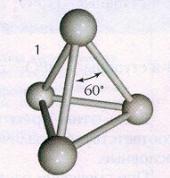 Modificarea albă a fosforului rezultată din condensarea vaporilor are o rețea cristalină moleculară, în nodurile căreia sunt dislocate moleculele P4 (Fig. 1). Datorită slăbiciunii forțelor intermoleculare, fosforul alb este volatil, fuzibil, tăiat cu un cuțit și dizolvat în solvenți nepolari, cum ar fi disulfura de carbon. Fosforul alb este o substanță foarte reactivă. Reacționează puternic cu oxigenul, halogenii, sulful și metalele. Oxidarea fosforului în aer este însoțită de încălzire și strălucire. Prin urmare, fosforul alb este stocat sub apă, cu care nu reacționează. Fosforul alb este foarte toxic.
Modificarea albă a fosforului rezultată din condensarea vaporilor are o rețea cristalină moleculară, în nodurile căreia sunt dislocate moleculele P4 (Fig. 1). Datorită slăbiciunii forțelor intermoleculare, fosforul alb este volatil, fuzibil, tăiat cu un cuțit și dizolvat în solvenți nepolari, cum ar fi disulfura de carbon. Fosforul alb este o substanță foarte reactivă. Reacționează puternic cu oxigenul, halogenii, sulful și metalele. Oxidarea fosforului în aer este însoțită de încălzire și strălucire. Prin urmare, fosforul alb este stocat sub apă, cu care nu reacționează. Fosforul alb este foarte toxic.
Aproximativ 80% din producția totală de fosfor alb merge la sinteza acidului fosforic pur. La rândul său, este folosit pentru a produce polifosfați de sodiu (sunt folosiți pentru a reduce duritatea apei de băut) și fosfați alimentari. Restul de fosfor alb este folosit pentru a crea substanțe care formează fum și amestecuri incendiare.
Ingineria sigurantei. În producerea fosforului și a compușilor săi sunt necesare precauții speciale, deoarece fosforul alb este o otravă puternică. Munca prelungită într-o atmosferă de fosfor alb poate duce la boli ale țesutului osos, pierderea dinților, necroza zonelor maxilarului. Când este aprins, fosforul alb provoacă arsuri dureroase care nu se vindecă mult timp. Fosforul alb trebuie depozitat sub apă, în recipiente ermetice. Arderea fosforului se stinge cu dioxid de carbon, o soluție CuSO 4 sau nisip. Pielea arsă trebuie spălată cu o soluție KmnO 4 sau CuSO 4. Antidotul pentru intoxicația cu fosfor este o soluție de 2%. CuSO4.
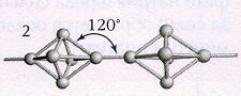 În timpul depozitării pe termen lung, precum și atunci când este încălzit, fosforul alb se transformă într-o modificare roșie (a fost primit pentru prima dată abia în 1847). Denumirea de fosfor roșu se referă la mai multe modificări simultan, care diferă în densitate și culoare: variază de la portocaliu la roșu închis și chiar violet. Toate soiurile de fosfor roșu sunt insolubile în solvenți organici și, în comparație cu fosforul alb, sunt mai puțin reactive și au o structură polimerică: acestea sunt tetraedre P4 legate între ele în lanțuri nesfârșite (Fig. 2).
În timpul depozitării pe termen lung, precum și atunci când este încălzit, fosforul alb se transformă într-o modificare roșie (a fost primit pentru prima dată abia în 1847). Denumirea de fosfor roșu se referă la mai multe modificări simultan, care diferă în densitate și culoare: variază de la portocaliu la roșu închis și chiar violet. Toate soiurile de fosfor roșu sunt insolubile în solvenți organici și, în comparație cu fosforul alb, sunt mai puțin reactive și au o structură polimerică: acestea sunt tetraedre P4 legate între ele în lanțuri nesfârșite (Fig. 2).
Fosforul roșu este folosit în metalurgie, producția de materiale semiconductoare și lămpi cu incandescență și este folosit în producția de chibrituri.
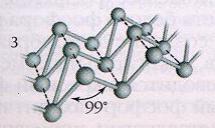 Cea mai stabilă modificare a fosforului este fosforul negru. Se obtine prin transformarea alotropica a fosforului alb cu t=2200 C și presiune crescută. În aparență, seamănă cu grafitul. Structura cristalină a fosforului negru este stratificată, constând din straturi ondulate (Fig. 3). Fosforul negru este cea mai puțin activă modificare a fosforului. Când este încălzit fără acces la aer, acesta, ca și roșu, trece în vapori, din care se condensează în fosfor alb.
Cea mai stabilă modificare a fosforului este fosforul negru. Se obtine prin transformarea alotropica a fosforului alb cu t=2200 C și presiune crescută. În aparență, seamănă cu grafitul. Structura cristalină a fosforului negru este stratificată, constând din straturi ondulate (Fig. 3). Fosforul negru este cea mai puțin activă modificare a fosforului. Când este încălzit fără acces la aer, acesta, ca și roșu, trece în vapori, din care se condensează în fosfor alb.
Oxid de fosfor (V).
P2+5O5 Anhidridă fosforică (oxid de fosfor (V))
cristale albe, t 0pl.= 5700C, t 0bp.= 6000 C, r = 2,7 g/cm3. Are mai multe modificari. Vaporii sunt formați din molecule P4H 10, foarte higroscopic (folosit ca desicant pentru gaze și lichide).
Chitanță
4 P + 5 O 2 ® 2 P 2 O 5
Proprietăți chimice
Toate proprietățile chimice ale oxizilor acizi: reacționează cu apa, oxizii bazici și alcalii
1) P205 + H20®2HPO 3 (acid metafosforic)
P2O5 + 2H2O® H4P2O 7 (acid pirofosforic)
P2O5 + 3H2O®2H3PO 4 (acid fosforic)
2) P2O5 + 3BaO® Ba3(PO4)2
În funcție de excesul de alcali, formează săruri medii și acide:
Fosfat acid de sodiu
Fosfat dihidrogen de sodiu
Datorită higroscopicității sale excepționale, oxidul de fosfor (V) este utilizat în tehnologia de laborator și industrială ca agent de uscare și deshidratare. În efectul său de uscare, depășește toate celelalte substanțe. Apa legată chimic este îndepărtată din acidul percloric anhidru pentru a forma anhidrida acestuia:
Acid ortofosforic.
Sunt cunoscuți mai mulți acizi care conțin fosfor. Cel mai important dintre ele este acidul ortofosforic H3PO4 (Fig. 5).
Acidul fosforic anhidru este un cristal ușor transparent, deliquescent în aer la temperatura camerei. Punct de topire 42,350C. Cu apă, acidul fosforic formează soluții de orice concentrație.
Acidul ortofosforic corespunde următoarei formule structurale:
DAR EL
OH OH
În laborator, acidul fosforic se obține prin oxidarea fosforului cu 30% acid azotic:
În industrie, acidul fosforic se obține în două moduri: extracție și termică.
1. Metoda de extracție se bazează pe tratarea fosfaților naturali zdrobiți cu acid sulfuric:
Acidul fosforic este apoi filtrat și concentrat prin evaporare.
2. Metoda termică constă în reducerea fosfaților naturali la fosfor liber, urmată de arderea acestuia la P4O10 și dizolvarea acestuia din urmă în apă. Acidul ortofosforic produs prin această metodă se caracterizează prin puritate mai mare și concentrație crescută (până la 80% în greutate).
proprietăți fizice. Acidul ortofosforic este o substanță solidă, incoloră, cristalină, foarte solubilă în apă.
Proprietățile chimice ale acidului fosforic sunt prezentate în Tabelul 2:
masa 2
Proprietățile chimice ale acidului fosforic
|
Frecvent cu alți acizi |
Specific |
|
1. O soluție apoasă de acid schimbă culoarea indicatorilor. Disocierea are loc în pași: Cea mai ușoară cale este disocierea de-a lungul primei etape și cea mai dificilă - a treia. 2. Reacţionează cu metalele situate în rândul de deplasare la hidrogen: 3. Reacţionează cu oxizii bazici: 4. Reactioneaza cu bazele si amoniacul; dacă acidul este luat în exces, se formează săruri acide: fosfat acid de sodiu fosfat dihidrogen de sodiu 5. Reacţionează cu sărurile acizilor slabi:
|
Când este încălzit, se transformă treptat în acid metafosforic: difosfor acid 2. Sub acțiunea unei soluții de azotat de argint ( eu ) apare un precipitat galben: galben Sediment
3. Acidul fosforic joacă mare rolîn viața animalelor și a plantelor. Reziduurile sale fac parte din acidul ATP adenozin trifosforic. Descompunerea ATP eliberează o cantitate mare de energie. |
Ortofosfați.
Acidul ortofosforic formează trei serii de săruri. Dacă notăm atomii de metal cu litere Pe mine , atunci este posibil să se descrie în termeni generali compoziția sărurilor sale (Tabelul 3).
Tabelul 3
Formule chimice ale ortofosfaților care conțin metale
|
monovalent |
divalent |
trivalent |
|
Me3PO4 |
Ortofosfați Me3(PO4)2 |
Me3PO4 |
|
Me2HPO4 |
Ortofosfați de hidrogen MenHPO4 |
Me2(HPO4)3 |
|
MeH2PO4 |
Dihidroortofosfați Me(H2PO4)2 |
Me(H2PO4)3 |
În loc de un metal monovalent, compoziția moleculelor de ortofosfat poate include o grupă de amoniu: ( NH4)3PO 4 - ortofosfat de amoniu;
(NH4)2HP0 4-ortofosfat hidrogen de amoniu; NH4H2PO 4 - dihidro-ortofosfat de amoniu.
Ortofosfații de calciu și amoniu și ortofosfații hidrogenați sunt utilizați pe scară largă ca îngrășăminte, ortofosfatul de sodiu și ortofosfatul hidrogenat sunt folosiți pentru a precipita sărurile de calciu din apă.
Fosforul în corpul uman
Într-un corp uman care cântărește 70 kg. Conține aproximativ 780 g de fosfor. Sub formă de fosfați de calciu, fosforul este prezent în oasele oamenilor și ale animalelor. De asemenea, este inclus în compoziția proteinelor, fosfolipidelor, acizilor nucleici; compușii fosforului sunt implicați în metabolismul energetic (acid adenizin trifosforic, ATP). Necesarul zilnic de fosfor al organismului uman este de 1,2 g. Consumăm cea mai mare parte din acesta cu lapte și pâine (100 g de pâine conțin aproximativ 200 mg de fosfor). Peștele, fasolea și unele tipuri de brânză sunt cele mai bogate în fosfor.
Interesant este că pentru o alimentație adecvată este necesar să se mențină un echilibru între cantitatea de fosfor și calciu consumată: raportul optim în aceste elemente alimentare este de 1,5.¸ 1. Un exces de alimente bogate în fosfor duce la scurgerea calciului din oase, iar cu un exces de calciu se dezvoltă urolitiaza.
Chibrituri
Suprafața incendiară a cutiei de chibrituri este acoperită cu un amestec de fosfor roșu și pulbere de sticlă. Compoziția capului de chibrit include agenți oxidanți ( Pb02, KCl03, BaCrO 4) și agenți reducători ( S, Sb 2 S 3). Cu frecarea de la suprafața incendiară, amestecul aplicat pe chibrit se aprinde:
Primele chibrituri de fosfor - cu cap de fosfor alb - au fost create abia în 1827. Astfel de chibrituri luau foc la frecare de orice suprafață, ceea ce ducea adesea la incendii. În plus, fosforul alb este foarte toxic. Sunt descrise cazuri de otrăvire cu chibrituri de fosfor, atât din cauza manipulării neglijente, cât și în scop de sinucidere: pentru aceasta a fost suficient să mănânci câteva capete de chibrit. De aceea, chibriturile de fosfor au fost înlocuite cu altele sigure, care ne servesc cu fidelitate până astăzi. Producția industrială de chibrituri de siguranță a început în Suedia în anii 60. al XIX-lea.
Îngrășăminte fosfatice
Îngrășămintele minerale sunt o sursă de diferiți nutrienți pentru plante și proprietățile solului, în primul rând azot, fosfor și potasiu, iar apoi calciu, magneziu, sulf și fier.
Fosforul este un constituent al multor compuși organici din plante. Nutriția cu fosfor reglează creșterea și dezvoltarea plantelor.
Materiile prime pentru producerea îngrășămintelor cu fosfat, fosfor și toți compușii fosforici sunt minereurile de apatită și fosforit. Compoziția apatitelor este exprimată cel mai adesea prin formula Ca5(PO4)3 F (fluorapatită). Fosforiții diferă de fluorapatite prin aceea că în loc de ioni din ele F - contine OH- sau ioni. Fosforiții conțin de obicei mai multe impurități decât fluorapatita.
ÎN Rusia prerevoluționară au fost cunoscute și dezvoltate doar depozite subțiri de fosforiți de calitate scăzută. Prin urmare, un eveniment de mare importanță economică națională a fost descoperirea în anii 1920 a unui zăcământ de apatită pe Peninsula Kola din Khibiny. Aici a fost construită o mare fabrică de procesare, care separă roca extrasă într-un concentrat cu un conținut ridicat de fosfor și impurități - „cozi de nefeline” folosite pentru a produce aluminiu, sodă, potasiu și ciment.
În sudul Kazahstanului, în munții Karatau, au fost descoperite zăcăminte puternice de fosforiți.
Cel mai ieftin îngrășământ fosfat este fosforit - rocă fosfatică măcinată fin. Fosforul este conținut în el sub formă de fosfat de calciu Ca3 (PO4) insolubil în apă. Prin urmare, fosforiții nu sunt asimilați de toate plantele și nu pe toate solurile. Cea mai mare parte a minereurilor fosfatice extrase sunt procesate prin metode chimice în substanțe disponibile pentru toate plantele de pe orice sol. Aceștia sunt fosfați de calciu solubili în apă:
Superfosfat dublu (culoarea și aspectul sunt similare cu superfosfatul simplu - o pulbere gri cu granulație fină).
Obținut prin acțiunea fosfatului natural de acid fosforic:
În comparație cu superfosfatul simplu, nu conține Ca S O4 și este un îngrășământ foarte concentrat (conține până la 50% P2O5).
Precipitat - conține 35-40% Р2О5.
Obținut prin neutralizarea acidului fosforic cu o soluție de hidroxid de calciu:
Folosit pe soluri acide.
Ammophos este un îngrășământ complex care conține azot (până la 15% N ) și fosfor (până la 58% P2O5) sub formă NH4H2P04 şi (NH4)2HP0 4. Obținut prin neutralizarea acidului fosforic cu amoniac.
Anterior, de mai bine de 100 de ani, așa-numitul superfosfat simplu, care se formează prin acțiunea acidului sulfuric asupra fosfatului natural de calciu, a fost utilizat pe scară largă ca îngrășământ fosfat:
În acest caz, acid sulfuric reacționează relativ mai puțin cu fosfatul de calciu decât atunci când se obține acid fosforic din acesta. Se obține un amestec de dihidrogenofosfat de calciu și sulfat de calciu. Acesta este un îngrășământ cu o fracție de masă de P2O5 nu mai mare de 20%. Acum superfosfatul simplu este produs la scară relativ mică în instalațiile construite anterior.
Exemple de îngrășăminte fosfatice sunt date în tabelul 4.
Tabelul 4
Îngrășăminte care conțin fosfor
|
Valoarea fosforului Acid fosforic este de mare importanță ca una dintre cele mai importante componente ale nutriției plantelor. Fosforul este folosit de plante pentru a-și construi cele mai vitale părți importante- seminte si fructe. Derivații acidului ortofosforic sunt foarte necesari nu numai pentru plante, ci și pentru animale. Oasele, dinții, scoici, gheare, ace, vârfuri în majoritatea organismelor vii constau în principal din ortofosfat de calciu. În plus, acidul fosforic, formând diverși compuși cu substanțe organice, este implicat activ în metabolismul unui organism viu cu mediul. Ca urmare, derivații de fosfor se găsesc în oase, creier, sânge, mușchi și țesuturi conjunctive ale organismelor umane și animale. Există mai ales mult acid fosforic în compoziția celulelor nervoase (creierului), ceea ce a permis A.E. Fersman, un geochimist celebru, a numit fosforul „elementul gândirii”. Un efect foarte negativ (boala animalelor cu rahitism, anemie etc.) afectează starea organismului prin scăderea conținutului de compuși ai fosforului din dietă sau prin introducerea acestora într-o formă nedigerabilă. Utilizarea fosforului Acidul ortofosforic este utilizat în prezent pe scară largă. Principalul său consumator este producția de fosfat și îngrășăminte combinate. În aceste scopuri, aproximativ 100 de milioane de tone de minereu care conțin fosfor sunt extrase anual în întreaga lume.Îngrășămintele cu fosfor nu numai că ajută la creșterea randamentului diferitelor culturi, dar oferă plantelor rezistență la iarnă și rezistență la alte condiții climatice nefavorabile, creează condiții. pentru o coacere mai rapida a culturilor in zonele cu perioada vegetativa scurta. De asemenea, au un efect benefic asupra solului, contribuind la structurarea acestuia, la dezvoltarea bacteriilor din sol, modificând solubilitatea altor substanțe conținute în sol și suprimând unele dintre substanțele organice nocive rezultate. O mulțime de acid ortofosforic este consumat de industria alimentară. Faptul este că acidul fosforic diluat are un gust foarte plăcut, iar micile sale adaosuri la marmelade, limonade și siropuri le îmbunătățesc semnificativ gustul. Unele săruri ale acidului fosforic au aceeași proprietate. Fosfații hidrogenați de calciu, de exemplu, au fost incluși de mult în praful de copt, îmbunătățind gustul chiflelor și al pâinii. Alte aplicații industriale ale acidului fosforic sunt de asemenea de interes. De exemplu, s-a observat că impregnarea lemnului cu acidul însuși și sărurile sale face lemnul incombustibil. Vopsele ignifuge, plăci de lemn fosfor incombustibil, spumă de fosfat incombustibilă și alte materiale de construcție sunt acum produse pe această bază. Diverse săruri ale acidului fosforic sunt utilizate pe scară largă în multe industrii, în construcții, în diverse domenii ale tehnologiei, în utilitățile publice și viața de zi cu zi, pentru protecția împotriva radiațiilor, pentru dedurizarea apei, combaterea depunerilor de cazane și fabricarea diverșilor detergenți. Acidul fosforic, acizii condensați și fosfații dehidrogenați servesc ca catalizatori în procesele de deshidratare, alchilare și polimerizare a hidrocarburilor. Un loc special îl ocupă compușii organofosforici ca extractanți, plastifianți, lubrifianți, aditivi pentru praf de pușcă și absorbanți în unitățile frigorifice. Sărurile de alchil fosfat acid sunt utilizate ca agenți tensioactivi, antigel, îngrășăminte speciale, anticoagulante de latex, etc. Alchil fosfatii acizi sunt utilizați pentru procesarea extracției lichidelor de minereu de uraniu. Bibliografie F.G. Feldman, G.E. Rudzitis. CHIMIE. Manual pentru instituțiile de învățământ clasa a 9-a. - M., ediția a V-a, LUMINĂRI, 1997. CHIMIE. Materiale de referinta. Sub conducerea lui Yu.D. Tretyakov, - M., EDUCAȚIE, 1984. CHIMIE. Manualul școlarilor, - M., 1995. CHIMIE. Enciclopedie pentru copii. Volumul 17, AVANTA, 2000. Weser V.-J., Fosforul și compușii săi, trad. din engleză, - M., 1963. |
Fosforul este o substanță vitală, face parte din toate țesuturile corpului, în special din mușchi și creier, este implicat în toate tipurile de metabolism, este necesar pentru functionare normala sistemul nervos, mușchiul inimii etc. Fosforul se găsește în țesuturile corpului și în produsele alimentare sub formă de acid fosforic și compuși organici ai acidului fosforic (fosfați). Masa sa principală se află în țesutul osos sub formă de fosfat de calciu, restul fosforului face parte din țesuturile moi și fluide. În mușchi are loc cel mai intens schimb de compuși ai fosforului. Acidul fosforic este implicat în construcția moleculelor multor enzime, acizi nucleici etc.
Conținutul de compuși organici ai fosforului din sângele uman variază considerabil. Cu toate acestea, cantitatea de fosfor anorganic este mai mult sau mai puțin constantă - 3 - 5,5 mg%. Conținutul de fosfor anorganic crește cu o dietă cu lapte, precum și cu o serie de boli de rinichi, cu fracturi în stadiul de vindecare. diabet zaharat, acromegalie, boala Addison etc.; concentrația de fosfor anorganic în serul sanguin scade odată cu creșterea funcției glandelor paratiroide și cu o serie de alte boli. În timpul înfometării, organismul consumă fosfor conținut în țesuturi, astfel încât concentrația acestuia în sânge nu se modifică și numai odată cu pierderea a 40% din cantitatea totală, conținutul său în sânge scade cu 10%.
Trebuie remarcat faptul că înfometarea completă are un efect mai mic asupra conținutului de fosfor anorganic din sânge decât parțial, atunci când raportul dintre fosfor, calciu și magneziu este brusc perturbat, ceea ce duce la creșterea excreției de fosfor din organism. Furnizarea organismului cu fosfor este determinată nu numai de conținutul său absolut din alimente, ci și de raportul său cu alte componente ale alimentelor. De exemplu, raportul dintre fosfor și proteine din alimente ar trebui să fie de cel puțin 1:40.
Norma zilnică de fosfor pentru un adult este de 1600 mg, necesarul pentru femeile însărcinate este de 3000 mg, iar pentru mamele care alăptează 3800 mg pe zi (la copii este mai mare decât la adulți). Echilibrul fosforului din organism depinde de starea generală a metabolismului. Încălcarea metabolismului fosforului duce la modificări biochimice profunde, în primul rând în metabolismul energetic.
Compușii anorganici ai fosforului, în primul rând fosfatul anorganic din sânge, joacă un rol esențial în menținerea echilibrului acido-bazic. Fosforul face parte din cei mai importanți compuși organici fosforilați ai organismului: nucleotide, acizi nucleici, fosfolipide, fosfoproteine, esteri fosforici ai carbohidraților, vitamine, coenzime și alți compuși implicați în diferite procese metabolice și joc. Rol cheieîn viața unui organism.
Fosforul este prezent în celulele vii sub formă de acizi orto- și pirofosforici și derivați ai acestora și, de asemenea, face parte din nucleotide, acizi nucleici, fosfoproteine, fosfolipide, esteri fosforici ai carbohidraților, multe coenzime și alți compuși organici. Datorită particularităților structurii chimice, atomii de fosfor, ca și atomii de sulf, sunt capabili să formeze legături bogate în energie în compuși cu energie înaltă: acid adenozin trifosforic (ATP), creatină fosfat și altele. În procesul de evoluție biologică, compușii fosforului au devenit principalii păstrători universali ai informațiilor genetice și ai purtătorilor de energie în toate sistemele vii. Un alt rol important al compușilor de fosfor în organism este că adăugarea enzimatică a unui reziduu de fosforil la diverși compuși organici (fosforilare) servește drept „pasare” pentru participarea lor la metabolism și, dimpotrivă, scindarea unui reziduu fosforil (defosforilare). exclude acești compuși din schimbul activ. Enzime ale metabolismului fosforului - kinaze, fosforilaze și fosfataze. rol principalîn transformările compușilor fosforului din corpul uman, ficatul joacă. Metabolismul fosforului este reglat de hormoni și vitamina D.
Consecințele deficienței sau excesului de fosfor în organism
Cu o lipsă de fosfor în organism, o persoană dezvoltă osteoporoză și alte boli osoase. Copiii dezvoltă rahitism.
Surse de fosfor
Fosforul pătrunde în organism în principal cu produse de origine animală - lapte și produse lactate, carne, pește, ouă etc. Dintre produsele alimentare, brânza, carnea, ouăle, boabele de leguminoase (mazăre, fasole și altele) sunt cele mai bogate în fosfor. .
Fosforul este o substanță vitală, face parte din toate țesuturile corpului, în special din mușchi și creier, participă la toate tipurile de metabolism, este necesar pentru funcționarea normală a sistemului nervos, a mușchiului inimii etc. Fosforul se găsește în organism. țesuturi și produse alimentare sub formă de acid fosforic și compuși organici ai acidului fosforic (fosfați). Masa sa principală se află în țesutul osos sub formă de fosfat de calciu, restul fosforului face parte din țesuturile moi și fluide. În mușchi are loc cel mai intens schimb de compuși ai fosforului. Acidul fosforic este implicat în construcția moleculelor multor enzime, acizi nucleici etc.
Conținutul de compuși organici ai fosforului din sângele uman variază considerabil. Cu toate acestea, cantitatea de fosfor anorganic este mai mult sau mai puțin constantă - 3 - 5,5 mg%. Conținutul de fosfor anorganic crește cu o dietă cu lapte, precum și cu o serie de boli de rinichi, cu fracturi în stadiul de vindecare. diabet zaharat, acromegalie, boala Addison etc.; concentrația de fosfor anorganic în serul sanguin scade odată cu creșterea funcției glandelor paratiroide și cu o serie de alte boli. În timpul înfometării, organismul consumă fosfor conținut în țesuturi, astfel încât concentrația acestuia în sânge nu se modifică și numai odată cu pierderea a 40% din cantitatea totală, conținutul său în sânge scade cu 10%.
Trebuie remarcat faptul că înfometarea completă are un efect mai mic asupra conținutului de fosfor anorganic din sânge decât parțial, atunci când raportul dintre fosfor, calciu și magneziu este brusc perturbat, ceea ce duce la creșterea excreției de fosfor din organism. Furnizarea organismului cu fosfor este determinată nu numai de conținutul său absolut din alimente, ci și de raportul său cu alte componente ale alimentelor. De exemplu, raportul dintre fosfor și proteine din alimente ar trebui să fie de cel puțin 1:40.
Norma zilnică de fosfor pentru un adult este de 1600 mg, necesarul pentru femeile însărcinate este de 3000 mg, iar pentru mamele care alăptează 3800 mg pe zi (la copii este mai mare decât la adulți). Echilibrul fosforului din organism depinde de starea generală a metabolismului. Încălcarea metabolismului fosforului duce la modificări biochimice profunde, în primul rând în metabolismul energetic.
Compușii anorganici ai fosforului, în primul rând fosfatul anorganic din sânge, joacă un rol esențial în menținerea echilibrului acido-bazic. Fosforul face parte din cei mai importanți compuși organici fosforilați ai organismului: nucleotide, acizi nucleici, fosfolipide, fosfoproteine, esteri fosforici ai carbohidraților, vitamine, coenzime și alți compuși implicați în diferite procese metabolice și care joacă un rol cheie în viața organismului. corp.
Fosforul este prezent în celulele vii sub formă de acizi orto- și pirofosforici și derivați ai acestora și, de asemenea, face parte din nucleotide, acizi nucleici, fosfoproteine, fosfolipide, esteri fosforici ai carbohidraților, multe coenzime și alți compuși organici. Datorită particularităților structurii chimice, atomii de fosfor, ca și atomii de sulf, sunt capabili să formeze legături bogate în energie în compuși cu energie înaltă: acid adenozin trifosforic (ATP), creatină fosfat și altele. În procesul de evoluție biologică, compușii fosforului au devenit principalii păstrători universali ai informațiilor genetice și ai purtătorilor de energie în toate sistemele vii. Un alt rol important al compușilor de fosfor în organism este acela că adăugarea enzimatică a unui reziduu de fosforil la diverși compuși organici (fosforilare) servește drept „pasare” pentru participarea lor la metabolism și, dimpotrivă, scindarea unui reziduu fosforil (defosforilare). exclude acești compuși din schimbul activ. Enzime ale metabolismului fosforului - kinaze, fosforilaze și fosfataze. Rolul principal în transformarea compușilor fosforului în corpul uman este jucat de ficat. Metabolismul fosforului este reglat de hormoni și vitamina D.
Fosforul (P) este un element chimic cu număr atomic 15. Numele său în limba rusă în limba greacă înseamnă „purtător de lumină”. Împreună cu azotul, aparține grupului așa-numiților pnictogeni.
Fosforul este unul dintre cele mai comune elemente chimice de pe Pământ. Conținutul său în scoarța terestră este de aproape 0,1% din masa sa. ÎN apa de mare concentrația medie de fosfor este de 0,07 mg/l.
Acesta este un element foarte activ din punct de vedere chimic, deci nu apare în natură în stare liberă. Este inclus în destul un numar mare minerale (aproximativ 200), dintre care cele mai comune sunt apatita și fosforitul.
Fosforul a fost descoperit în 1669 de alchimistul din Hamburg Henning Brand, care, așa cum se presupunea că ar fi fost după statut, căuta o piatră filosofală, dar a primit o substanță luminoasă neobișnuită. Apropo, subiectul manipulărilor sale chimice a fost urina umană, deoarece experimentatorul a crezut că asta galben datorita aurului pe care il contine. Astfel, fosforul a fost descoperit destul de întâmplător. Și așa a fost.
Brand a apărat urina timp de câteva zile până a dispărut miros urât. Apoi l-a evaporat într-o stare asemănătoare jeleului, obținând un fel de pastă. Apoi, a încălzit ingredientul rezultat la temperaturi ridicate până când au apărut bule. După câteva ore de o astfel de fierbere, s-au obținut boabe dintr-o substanță albă, asemănătoare ceară, care se aprindeau ușor și străluceau în întuneric. Apropo, încă din antichitate, aceasta a fost prima descoperire element chimic, deși există o părere că arabii au învățat să extragă fosfor pur în secolul al XII-lea. În ciuda tuturor acestor descoperiri, doar chimistul francez Lavoisier a reușit să stabilească că fosforul este o substanță simplă, nu un compus chimic. Ulterior, oamenii de știință natural au descoperit multe altele proprietăți uimitoare acest element extravagant.
În special, sa constatat că fosforul există în mai multe modificări alotropice, dintre care unele nu au fost încă studiate. În anumite condiții, fosforul devine un adevărat metal. Cele mai bine studiate sunt modificările fosforului precum alb, roșu, negru și metalic. Fosforul alb este cea mai instabilă modificare și în condiții normale se transformă în roșu. Cel mai activ din punct de vedere chimic este fosforul alb, cel mai puțin - negru. Fosforul roșu din punct de vedere al activității chimice ocupă o poziție intermediară între alb și negru. Îl știm în măsura în care se aprinde ușor la impact sau frecare, de aceea este utilizat pe scară largă la producerea celor mai comune chibrituri (suprafața răzătoarei cutiilor de chibrituri este " chirkash").
Fosforul alb arde chiar și în apă, este foarte otrăvitor (o singură doză letală pentru un adult este de 0,05-0,15 g, adică nu este inferioară ca toxicitate față de cianura de potasiu). În otrăvirea cronică cu fosfor alb, țesutul osos este afectat, ceea ce poate duce, de exemplu, la necroza maxilarelor. Este absolut imposibil să-l iei în mâini, deoarece la contactul cu pielea se aprinde imediat, lăsând arsuri foarte severe.
Rolul fosforului în corpul uman
Fosforul este un organogen și, în forme cunoscute nouă, viața pe Pământ fără el ar fi imposibilă. Acest lucru este ușor de înțeles dacă știi că fosforul este un element constitutiv al ADN-ului - principalul purtător al informațiilor genetice despre organismele vii. Reproducere fără ADN forme cunoscute viata este imposibila. Prin urmare, fosforul se găsește în toate ființele vii. În plante, este prezent într-o concentrație sau alta aproape peste tot, cu toate acestea, este mai mult în fructe și semințe. În ceea ce privește animalele, acesta poate fi găsit și acolo în toate părțile corpului, dar ponderea principală a elementului luminifer este concentrată în oase.
Fosforul face parte din multe proteine și alți compuși organici importanți (ADN-ul deja menționat, principalul „combustibil” al unei celule vii - ATP, precum și fosfolipide, enzime, coenzime etc.). Partea principală a fosforului din corpul uman este concentrată în oase (ca și la toate celelalte vertebrate). În smalțul dinților, fosforul este prezent în compoziția fluorapatitei. De aceea, cu lipsa de fosfor, se dezvoltă în primul rând bolile oaselor și dinților.
Principalul laborator chimic pentru conversia compușilor fosforului în corpul uman este ficatul.
Necesarul zilnic de fosfor la un adult este de 1-2 g. Dar un organism tânăr și în creștere are nevoie de aproximativ 1,5-2,5 g de fosfor pe zi, femeile însărcinate și mamele care alăptează chiar mai mult - 3,0-3,8 g/zi Cu efort fizic intens, necesarul de fosfor crește de 1,5-2 ori.
Corpul unui adult conține 500-750 g de fosfor, iar 90% din acesta este concentrat în dinți și oase.
Făcând parte din fosfolipide și fosfoproteine, fosforul joacă rol esentialîn construirea membranelor celulare.
Fosforul face parte din molecula de ATP (adenozin trifosfat), care este necesară celulelor pentru a transforma proteinele, grăsimile și carbohidrații în energie. Nu este o coincidență că ATP este numit acumulator de energie. Apropo, aproximativ 60 kg de ATP sunt sintetizate zilnic în corpul uman! Dar asta nu înseamnă deloc că corpul nostru conține întotdeauna așa ceva o cantitate mare această legătură. Faptul este că ATP este convertit în mod constant (și foarte rapid) în ADP (adenozin difosfat) și invers.
În sistemul nervos uman, fosforul joacă, de asemenea, un rol cheie, deoarece compușii săi sunt direct implicați în transmiterea impulsurilor nervoase.
Fosforul activează multe enzime din corpul nostru, precum și vitamina D și vitaminele B.
Este implicat in mentinerea echilibrului acido-bazic al organismului, imbunatateste absorbtia glucozei si a multor alte substante necesare si benefice organismului.
Astfel, valoarea fosforului pentru corpul uman poate fi redusă la următoarele:
- asigurarea creșterii și refacerii organismului;
- asigurarea schimbului de energie;
- face parte din oase;
- fără el, existența ADN-ului este imposibilă - principalul material genetic de construcție;
- coordonarea echilibrului acido-bazic;
- activarea reacțiilor enzimatice;
- transmiterea unui impuls nervos.
Surse de fosfor pentru corpul uman
Fosforul este un element ușor digerabil. Aproximativ 70% din fosforul care vine cu alimente este implicat în metabolism, iar fosforul care face parte din pește și fructe de mare este absorbit cu aproape 100%.
Următoarele alimente sunt cele mai bogate în fosfor:
- lapte și produse lactate (în special brânzeturi) (până la 550 mg%);
- carne, pasare, oua, in special ficat (380-500 mg%);
- fasole și mazăre (300-500 mg%);
- pește și caviar negru (aproximativ 350 mg%);
- cereale (secara, grau, ovaz), hrişcă(250-300 mg%);
- nuci și semințe;
- verdeturi si legume (patrunjel, spanac, dovleac, varza, morcovi, usturoi etc.) (100-150 mg%).
Cel mai bun lucru corpul uman fosforul este absorbit prin combinarea compușilor săi cu substanțe care conțin calciu (raportul optim P:Ca este de 3:2.
Când utilizați produse din fosfor, trebuie să cunoașteți măsura, deoarece excesul său poate duce la consecințe destul de neplăcute.
Deficiența de fosfor în corpul uman
tipic cauzele deficitului de fosforîn corpul uman sunt:
- tulburări metabolice și boli asociate, de exemplu, alcoolism, diabet zaharat, disfuncție tubulară renală, disfuncție tiroidiană și paratiroidă;
- aport insuficient din alimente;
- nevoie crescută datorită efortului fizic ridicat, fazelor de creștere ale corpului, sarcinii și alăptării;
- foame;
- aportul excesiv de compuși de magneziu, aluminiu, calciu și bariu în organism (ionii acestor metale formează compuși insolubili cu fosfor, prin urmare elimină fosforul din metabolism);
- consumul excesiv de băuturi carbogazoase (consecințele sunt similare cu cele anterioare);
- intoxicație alimentară;
De asemenea, instalat. că persoanele obeze pot dezvolta o lipsă de fosfor din cauza faptului că țesutul adipos, așa cum spune, selectează compușii fosforului din țesutul conjunctiv (oase), precum și din organe interne(mai ales ficatul si creierul sufera). Din acest motiv, persoanele obeze suferă de ficat gras, apatie și somnolență, cad cu ușurință în depresie și au tulburări la nivelul sistemului musculo-scheletic.
Copiii artificiali pot avea, de asemenea, o lipsă de fosfor.
Simptome de deficit de fosfor:
- epuizare, lipsa poftei de mâncare, slăbiciune și senzație de slăbiciune;
- durere în mușchi, oase și articulații;
- imunitatea slăbită, în special la răceli;
- ficat gras;
- modificări distrofice ale miocardului;
- erupții cutanate hemoragice pe piele și pe suprafața mucoasei;
- boli parodontale, rahitism;
- boală mintală.
Excesul de fosfor
În primul rând, să considerăm o astfel de cauză a excesului de fosfor ca o otrăvire de către acesta, care apare cel mai adesea la persoanele care sunt forțate de profesie să contacteze adesea cu acesta.
După cum am menționat deja, fosforul alb este cel mai otrăvitor. Când sunt otrăviți, aceștia prezintă următoarele simptome:
- arsuri în gură și stomac;
- slăbiciune;
- durere de cap;
- vărsături;
- icter (timp de 2-3 zile).
La intoxicații cronice se formează fosfor alb:
- încălcarea metabolismului calciului;
- afectarea sistemului cardiovascular și nervos.
Fosforul roșu este aproape inofensiv, dar otrăvirea cronică poate duce la pneumonie.
Unii compuși ai fosforului sunt atât de toxici încât sunt utilizați ca agenți de război chimic (tabun, sarin, soman, gaze V).
În ciuda acestui fapt, trebuie remarcat faptul că fosforul face parte din compușii organici care intră în corpul nostru cu alimente. complet netoxic. Cu toate acestea, aportul excesiv de compuși ai fosforului complet inofensivi în organism duce la dezvoltarea unui număr de boli.
Cauzele excesului de fosfor sunt:
- alimentație dezechilibrată cu un conținut ridicat de componente proteice (așa-numita „supraalimentare cu proteine”);
- utilizarea unui număr mare de conserve, limonade;
- tulburări metabolice.
Mai recent, deficiența de fosfor în corpul uman a fost mult mai frecventă decât excesul său. Cu toate acestea, utilizarea pe scară largă a compușilor de fosfor în industria alimentară a dat peste cap această statistică: acum medicii trebuie să trateze excesul de fosfor mult mai des decât lipsa acestuia.
În industria alimentară, următorii compuși ai fosforului sunt cel mai des utilizați:
- acid fosforic (E338);
- fosfat de potasiu (E340);
- fosfat de calciu (E341);
- fosfat de amoniu (E342);
- fosfat de magneziu (E343).
Datorită acestor compuși, astfel de produse alimentare în vrac, cum ar fi cafeaua, cacao, lapte praf și smântână praf, nu se îngrămădesc și nu se adună, laptele condensat nu se cristalizează, se asigură o consistență moale a brânzeturilor prelucrate (săruri de topire), termenul de valabilitate al lactate și produse din carne. Acidifică băuturile răcoritoare, măresc greutatea și volumul cârnaților și cărnurilor afumate.
Simptomele excesului de fosfor poate fi:
- depozite de sare;
- osteoporoza;
- boli ale sistemului digestiv, în special ale ficatului;
- scăderea coagulării sângelui, hemoragie;
- anemie;
- leucopenie (scăderea imunității).