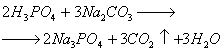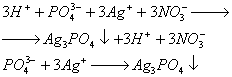Фосфор в организме человека. Фосфор и его соединения
Фосфор и его соединения
Экзаменационный реферат по химии выполнила Буточкина Оля, ученица 9 «д» класса
Развилковская средняя школа с углубленным изучением отдельных предметов
Москва, 2002 г.
Введение
Пятая группа Периодической системы включает два типических элемента азот и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими элементами наблюдается значительное различие в свойствах.
В состоянии простых веществ азот – газ, а фосфор – твердое вещество. Эти два вещества получили большую область применения, хотя когда азот впервые был выделен из воздуха его посчитали вредным газом, а на продаже фосфора удавалось заработать большое количество денег (в фосфоре ценили его способность светится в темноте).
История открытия фосфора
По иронии судьбы фосфор открывался несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль (XII век) открыл фосфор при перегонке мочи в смеси с глиной, известью и углем. Однако датой открытия фосфора считается 1669 год. Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, мечтавший с помощью алхимии поправить свои дела, подвергал обработке самые разнообразные продукты. Предполагая, что физиологические продукты могут содержать «первичную материю», считавшейся основой философского камня, Бранд заинтересовался человеческой мочей.
Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он вновь дистиллировал и получил тяжелое красное «уринное масло», которое перегонялось с образованием твердого остатка. Нагревая последний, без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившего в темноте. Бранд назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
Несколько лет «рецепт приготовления» фосфора хранился в строжайшем секрете и был известен лишь нескольким алхимикам. В третий раз фосфор открыл Р.Бойль в 1680 году.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергали смесь мочи с оксидом свинца (PbO ), поваренной солью (NaCl ), поташом (K 2 CO 3) и углем (C ). Лишь 1777 году К.В.Шееле заработал способ получения фосфора из рога и костей животных.
Природные соединения и получение фосфора
По распространенности в земной коре фосфор опережает азот, серу и хлор. В отличие от азота фосфор, из-за большой химической активности встречается в природе только в виде соединений. Наиболее важные минералы фосфора - апатит Са5Х(РО4)3 (Х - фтор, реже хлор и гидрооксильная группа) и фосфорит основой которого является Са3(РО4)2. Крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор. Залежи фосфоритов находятся в районе гор Каратау, в Московской, Калужской, Брянской областях и в других местах. Фосфор входит в состав некоторых белковых веществ, содержащихся в генеративных органах растений, в нервных и костных тканях организмов животных и человека. Особенно богаты фосфором мозговые клетки.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca3(PO4)2+3SiO2+5C ® 3CaSiO3+5CO +P2 .
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
Химические свойства
Электронная конфигурация атома фосфора
1 S 22 S 22 P 63 S 23 P 33 d 0
Наружный электронный слой содержит 5 электронов. Наличием трех неспаренных электронов на внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность фосфора равна 3.
Но на третьем энергетическом уровне имеются вакантные ячейки d -орбиталей, поэтому при переходе в возбужденное состояние 3 S -электроны будут разъединяться, переходить на d подуровень, что приводит к образованию 5-ти неспаренных элементов.
Таким образом, валентность фосфора в возбужденном состоянии равна 5.
В соединениях фосфор обычно проявляет степень окисления +5, реже +3, -3.
1. Реакции с кислородом:
4P0 + 5O2 2P2+5O5
(при недостатке кислорода: 4P0 + 3O2 2P2+3O3)
2. С галогенами и серой:
2P0 + 3Cl2 ® 2P+3Cl3
P0 + 5S P2+5S5
(галогениды фосфора легко разлагаются водой, например:
PCl3 + 3H2O
®
H3PO3 + 3HCl
PCl5 + 4H2O
®
H3PO4 + 5HCl)
3. С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O ® 3H3P+5O4 + 5N+2O
4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления - 3:
2P0 + 3Mg ® Mg3P2-3
(фосфид магния легко разлагается водой Mg3P2 + 6H2O ® 3Mg(OH)2 + 2PH3 (фосфин))
3Li + P ® Li3P-3
5. Со щелочью :
4P + 3NaOH + 3H2O ® PH3 + 3NaH2PO2
В реакциях (1,2,3) - фосфор выступает как восстановитель, в реакции (4) - как окислитель; реакция (5) - пример реакции диспропорционирования.
Фосфор может быть как восстановителем, так и окислителем.
Аллотропные изменения
В свободном состоянии фосфор образует несколько аллотропных видоизменений. Это объясняется тем, что атомы фосфора способны, взаимно соединяясь, образовывать кристаллические решетки различного типа.
Таблица 1
Физические свойства фосфора
|
Аллотропная модификация |
Плотность, г/см3 |
t пл, |
T кип, |
|
|
Белый |
1,73 |
44,1 |
280,5 |
Белый кристаллический порошок, ядовит, самовозгорается на воздухе. При 280-300°С переходит в красный |
|
Красный |
Возгоняется около 400°С |
Красный кристаллический или аморфный порошок, неядовит. При 220°С и 12 × 108 Па переходит в черный фосфор. Загорается на воздухе только при поджигании |
||
|
Черный |
При нагревании переходит в красный фосфор |
Графитоподобная структура. При нормальных условиях - полупроводник, под давлением проводит электрический ток как металл |
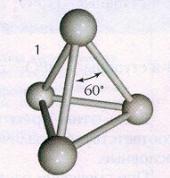 Белая модификация фосфора, получающаяся при конденсации
паров, имеет молекулярную кристаллическую решетку, в узлах которой
дислоцированы молекулы Р4 (рис.1). Из-за слабости межмолекулярных сил белый
фосфор летуч, легкоплавок, режется ножом и растворяется в
неполярных растворителях, например в сероуглероде. Белый фосфор весьма
реакционноспособное вещество. Он энергично взаимодействует с кислородом,
галогенами, серой и металлами. Окисление фосфора на воздухе сопровождается
разогреванием и свечением. Поэтому белый фосфор хранят под водой, с которой он
не реагирует. Белый фосфор очень токсичен.
Белая модификация фосфора, получающаяся при конденсации
паров, имеет молекулярную кристаллическую решетку, в узлах которой
дислоцированы молекулы Р4 (рис.1). Из-за слабости межмолекулярных сил белый
фосфор летуч, легкоплавок, режется ножом и растворяется в
неполярных растворителях, например в сероуглероде. Белый фосфор весьма
реакционноспособное вещество. Он энергично взаимодействует с кислородом,
галогенами, серой и металлами. Окисление фосфора на воздухе сопровождается
разогреванием и свечением. Поэтому белый фосфор хранят под водой, с которой он
не реагирует. Белый фосфор очень токсичен.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
Техника безопасности. В производстве фосфора и его соединений требуется соблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд. Продолжительная работа в атмосфере белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в герметичных сосудах. Горящий фосфор тушат двуокисью углерода, раствором CuSO 4 или песком. Обоженную кожу следует промыть раствором KmnO 4 или CuSO 4. Противоядием при отравлении фосфором является 2%-ый раствор CuSO 4.
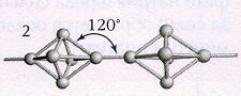 При длительном хранении, а также при нагревании белый
фосфор переходит в красную модификацию (впервые его получили лишь 1847 году).
Название красный фосфор относится сразу к нескольким модификациям,
различающихся по плотности и окраске:
она колеблется от оранжевой до темно-красной и даже фиолетовой. Все
разновидности красного фосфора нерастворимы в органических растворителях, и по
сравнению с белым фосфором они менее реакционноспособны и имеют полимерное
строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи (рис.2).
При длительном хранении, а также при нагревании белый
фосфор переходит в красную модификацию (впервые его получили лишь 1847 году).
Название красный фосфор относится сразу к нескольким модификациям,
различающихся по плотности и окраске:
она колеблется от оранжевой до темно-красной и даже фиолетовой. Все
разновидности красного фосфора нерастворимы в органических растворителях, и по
сравнению с белым фосфором они менее реакционноспособны и имеют полимерное
строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи (рис.2).
Красный фосфор находит применение в металлургии, производстве полупроводниковых материалов и ламп накаливания, используется в спичечном производстве.
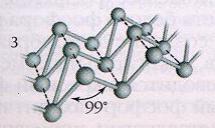 Наиболее стабильной модификацией фосфора является черный
фосфор. Его получают аллотропным превращением белого фосфора при
t
=2200
C
и повышенным давлением. По внешнему
виду он напоминает графит. Кристаллическая структура черного фосфора слоистая,
состоящая из гофрированных слоев (рис.3). Черный фосфор – это наименее активная модификация фосфора. При
нагревании без доступа воздуха он, как и красный, переходит в пар, из которого
конденсируется в белый фосфор.
Наиболее стабильной модификацией фосфора является черный
фосфор. Его получают аллотропным превращением белого фосфора при
t
=2200
C
и повышенным давлением. По внешнему
виду он напоминает графит. Кристаллическая структура черного фосфора слоистая,
состоящая из гофрированных слоев (рис.3). Черный фосфор – это наименее активная модификация фосфора. При
нагревании без доступа воздуха он, как и красный, переходит в пар, из которого
конденсируется в белый фосфор.
Оксид фосфора (V )
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые кристаллы, t 0пл.= 5700С, t 0кип.= 6000 C , r = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P 4 H 10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4 P + 5 O 2 ® 2 P 2 O 5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P 2 O 5 + H 2 O ® 2 HPO 3 (метафосфорная кислота)
P 2 O 5 + 2 H 2 O ® H 4 P 2 O 7 (пирофосфорная кислота)
P 2 O 5 + 3 H 2 O ® 2 H 3 PO 4 (ортофосфорная кислота)
2) P2O5 + 3BaO ® Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
Гидрофосфат натрия
Дигидрофосфат натрия
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием ее ангидрида:
Ортофосфорная кислота.
Известно несколько кислот, содержащих фосфор. Важнейшая из них - ортофосфорная кислота Н3РО4 (Рис.5).
Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,350С. С водой фосфорная кислота образует растворы любых концентраций.
Ортофосфорной кислоте соответствует следующая структурная формула:
НО ОН
О ОН
В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
В промышленности ортофосфорную кислоту получают двумя способами: экстракционным и термическим.
1. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
Ортофосфорная кислота затем отфильтровывается и концентрируется упариванием.
2. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4О10 и растворением последнего в воде. Производимая по данному методу ортофосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых).
Физические свойства. Ортофосфорная кислота - твердое, бесцветное, кристаллическое вещество, хорошо растворимое в воде.
Химические свойства ортофосфорной кислоты представлены в табл.2:
Таблица 2
Химические свойства ортофосфорной кислоты
|
Общие с другими кислотами |
Специфические |
|
1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато: Легче всего идет диссоциация по первой ступени и труднее всего – по третьей 2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода: 3. Реагирует с основными оксидами: 4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли: гидрофосфат натрия дигидрофосфат натрия 5. Реагирует с солями слабых кислот:
|
При нагревании постепенно превращается в метафосфорную кислоту: двуфосфорная кислота 2. При действии раствора нитрата серебра (I ) появляется желтый осадок: желтый Осадок
3. Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ. При разложении АТФ выделяется большое количество энергии. |
Ортофосфаты.
Ортофосфорная кислота образует три ряда солей. Если обозначить атомы металлов буквами Me , то можно изобразить в общем виде состав ее солей (табл.3).
Таблица 3
Химические формулы ортофосфатов, содержащих металлы
|
одновалентные |
двухвалентные |
трехвалентные |
|
Ме3РО4 |
Ортофосфаты Ме3(РО4)2 |
Ме3РО4 |
|
Ме2НРО4 |
Гидроортофосфаты МеНРО4 |
Ме2(НРО4)3 |
|
МеН2РО4 |
Дигидроортофосфаты Ме(Н2РО4)2 |
Ме(Н2РО4)3 |
Вместо одновалентного металла в состав молекул ортофосфатов может входить группа аммония: (NH 4)3 PO 4 - ортофосфат аммония;
(NH 4)2 HPO 4-гидроортофосфат аммония; NH 4 H 2 PO 4 – дигидро-ортофосфат аммония.
Ортофосфаты и гидроортофосфаты кальция и аммония широко используют в качестве удобрений, ортофосфат и гидроортофосфат натрия - для осаждения из воды солей кальция.
Фосфор в организме человека
В теле человека массой 70 кг. Содержится около 780 г. фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденизинтрифосфорная кислота, АТФ). Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра.
Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальцием: оптимальное соотношение в этих элементах пищи составляет 1,5 ¸ 1. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки входят окислители (PbO 2, KСlO3, BaCrO 4) и восстановители (S , Sb 2 S 3). При трении от зажигательной поверхности смесь, нанесенная на спичку, воспламеняется:
Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь 1827 г. Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Фосфорные удобрения
Минеральные удобрения – источник различных питательных элементов для растений и свойств почвы, в первую очередь азота, фосфора и калия, а затем кальция, магния, серы, железа.
Фосфор входит в состав многих органических соединений в растениях. Фосфорное питание регулирует рост и развитие растений.
Сырьем для производства фосфорных удобрений, фосфора и всех фосфорных соединений служат апатитовые и фосфоритовые руды. Состав апатитов чаще всего выражается формулой Са5(РО4)3 F (фторапатит). Фосфориты отличаются от фторапатитов тем, что в них вместо ионов F - содержатся ионы ОН- или . Фосфориты обычно содержат больше примесей, чем фторапатит.
В дореволюционной России были известны и разрабатывались лишь маломощные месторождения фосфоритов низкого качества. Поэтому событием огромного народнохозяйственного значения было открытие в 20-х годах месторождения апатита на Кольском полуострове в Хибинах. Здесь построена крупная обогатительная фабрика, которая разделяет добываемую горную породу на концентрат с высоким содержанием фосфора и примеси – «нефелиновые хвосты», используемые для производства алюминия, соды, поташа и цемента.
Мощные месторождения фосфоритов открыты в Южном Казахстане, в горах Каратау.
Самое дешевое фосфорное удобрение – это тонко измельченный фосфорит – фосфоритная мука. Фосфор содержится в ней в виде нерастворимого в воде фосфата кальция Са3(РО4)2. Поэтому фосфориты усваиваются не всеми растениями и не на всех почвах. Основную массу добываемых фосфорных руд перерабатывают химическими методами в вещества, доступные всем растениям на любой почве. Это водорастворимые фосфаты кальция:
Двойной суперфосфат (цвет и внешний вид сходен с простым суперфосфатом – серый мелкозернистый порошок).
Получается при действии на природный фосфат фосфорной кислоты:
По сравнению с простым суперфосфатом он не содержит Са S О4 и является значительно концентрированным удобрением (содержит до 50% Р2О5).
Преципитат – содержит 35-40% Р2О5.
Получается при нейтрализации фосфорной кислоты раствором гидроксида кальция:
Применяется на кислых почвах.
Аммофос – сложное удобрение, содержащее азот (до 15% N ) и фосфор (до 58% Р2О5) в виде NH 4 H 2 PO 4 и (NH 4)2 HPO 4. Получается при нейтрализации фосфорной кислоты аммиаком.
Раньше в течение более 100 лет в качестве фосфорного удобрения широко использовали так называемый простой суперфосфат, который образуется при действии серной кислоты на природный фосфат кальция:
В этом случае в реакцию с фосфатом кальция вступает относительно меньше серной кислоты, чем при получении из него фосфорной кислоты. Получается смесь дигидрофосфата кальция и сульфата кальция. Это удобрение с массовой долей Р2О5 не выше 20%. Сейчас простой суперфосфат производится в сравнительно небольших масштабах на ранее построенных заводах.
Примеры фосфорных удобрений даны в табл.4.
Таблица 4
Удобрения, содержащие фосфор
|
Значение фосфора Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется растениями для построения своих самых жизненно важных частей - семян и плодов. Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману , известному геохимику, назвать фосфор "элементом мысли". Весьма отрицательно (заболевание животных рахитом, малокровие, и др.) сказывается на состоянии организма понижение содержания в рационе питания соединений фосфора или введение их в неусвояемой форме. Применение фосфора Применяют ортофосфорную кислоту в настоящее время довольно широко. Основным ее потребителем служит производство фосфорных и комбинированных удобрений. Для этих целей ежегодно добывается во всем мире фосфоросодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структурированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ. Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба. Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы. Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств. Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов. Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков. Список литературы Ф.Г.Фельдман, Г.Е.Рудзитис. ХИМИЯ. Учебник для 9 класса общеобразовательных учреждений. – М., 5-е издание, ПРОСВЕЩЕНИЕ, 1997. ХИМИЯ. Справочные материалы. Под ред.Ю.Д.Третьякова, - М., ПРОСВЕЩЕНИЕ, 1984. ХИМИЯ. Справочник школьника, - М., 1995. ХИМИЯ. Энциклопедия для детей. Том 17, АВАНТА, 2000. Везер В.-Дж., Фосфор и его соединения, пер. с англ., - М., 1963. |
Фосфор относится к жизненно необходимым веществам, он входит в состав всех тканей организма, особенно мышц и мозга, участвует во всех видах обмена веществ, необходим для нормального функционирования нервной системы, сердечной мышцы и т. д. В тканях организма и пищевых продуктах фосфор содержится в виде фосфорной кислоты и органических соединений фосфорной кислоты (фосфатов). Основная его масса находится в костной ткани в виде фосфата кальция, остальной фосфор входит в состав мягких тканей и жидкостей. В мышцах происходит наиболее интенсивный обмен соединений фосфора. Фосфорная кислота участвует в построении молекул многих ферментов, нуклеиновых кислот и т. д.
Содержание органических соединений фосфора в крови человека меняется в значительных пределах. Однако количество неорганического фосфора более или менее постоянно - 3 - 5,5 мг% . Увеличивается содержание неорганического фосфора при молочной диете, а также при ряде заболеваний почек, при переломах в стадии заживления. сахарном диабете, акромегалии, аддисоновой болезни и др.; уменьшается концентрация неорганического фосфора в сыворотке крови при повышении функции паращитовидных желез и ряде других заболеваний. При голодании организм расходует фосфор, содержащийся в тканях, поэтому концентрация его в крови не меняется, и лишь при потере 40% общего количества содержание его в крови уменьшается на 10%.
Необходимо отметить, что полное голодание меньше отражается на содержании неорганического фосфора в крови, чем частичное, когда соотношение между фосфором, кальцием и магнием резко нарушается, что приводит к усиленному выведению фосфора из организма. Обеспеченность организма фосфором определяется не только абсолютным содержанием его в пище, но и его соотношением с другими компонентами пищи. Например, соотношение фосфора и белка в пище должно составлять по меньшей мере 1:40.
Суточной нормой фосфора для взрослого человека считают 1600 мг, потребность у беременных - 3000 мг, а у кормящих матерей 3800 мг в сутки (у детей она выше, чем у взрослых). Баланс Фосфора в организме зависит от общего состояния обмена веществ. Нарушение фосфорного обмена приводит к глубоким биохимическим изменениям, в первую очередь в энергетическом обмене.
Неорганические соединения фосфора, в первую очередь неорганический фосфат крови, играют существенную роль в поддержании кислотно-щелочного равновесия. Фосфор входит в состав важнейших органических фосфорилированных соединений организма: нуклеотидов, нуклеиновых кислот, фосфолипидов, фосфопротеидов, фосфорных эфиров углеводов, витаминов, коферментов и других соединений, участвующих в различных метаболических процессах и играющих ключевую роль в жизнедеятельности организма.
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих коферментов и других органических соединений. Благодаря особенностям химические строения атомы Фосфора, подобно атомам серы, способны к образованию богатых энергией связей в макроэргических соединениях: аденозинтрифосфорной кислоте (АТФ), креатинфосфате и других. В процессе биологической эволюции именно фосфорные соединения стали основными, универсальными хранителями генетической информации и переносчиками энергии во всех живых системах. Другая важная роль соединений Фосфора в организме заключается в том, что ферментативное присоединение фосфорильного остатка к различным органическим соединениям (фосфорилирование) служит как бы "пропуском" для их участия в обмене веществ, и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена фосфора - киназы, фосфорилазы и фосфатазы. Главную роль в превращениях соединений фосфора в организме человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
Последствия недостатка или избытка Фосфора в организме
При недостатке фосфора в организме у человека развиваются остеопороз и другие заболевания костей. У детей развивается рахит.
Источники Фосфора
Фосфор поступает в организм главным образом с продуктами животного происхождения - молоком и молочными продуктами, мясом, рыбой, яйцами и др. Из продуктов питания наиболее богаты Фосфором сыр, мясо, яйца, зерно бобовых культур (горох, фасоль и других).
Фосфор относится к жизненно необходимым веществам, он входит в состав всех тканей организма, особенно мышц и мозга, участвует во всех видах обмена веществ, необходим для нормального функционирования нервной системы, сердечной мышцы и т. д. В тканях организма и пищевых продуктах фосфор содержится в виде фосфорной кислоты и органических соединений фосфорной кислоты (фосфатов). Основная его масса находится в костной ткани в виде фосфата кальция, остальной фосфор входит в состав мягких тканей и жидкостей. В мышцах происходит наиболее интенсивный обмен соединений фосфора. Фосфорная кислота участвует в построении молекул многих ферментов, нуклеиновых кислот и т. д.
Содержание органических соединений фосфора в крови человека меняется в значительных пределах. Однако количество неорганического фосфора более или менее постоянно - 3 - 5,5 мг% . Увеличивается содержание неорганического фосфора при молочной диете, а также при ряде заболеваний почек, при переломах в стадии заживления. сахарном диабете, акромегалии, аддисоновой болезни и др.; уменьшается концентрация неорганического фосфора в сыворотке крови при повышении функции паращитовидных желез и ряде других заболеваний. При голодании организм расходует фосфор, содержащийся в тканях, поэтому концентрация его в крови не меняется, и лишь при потере 40% общего количества содержание его в крови уменьшается на 10%.
Необходимо отметить, что полное голодание меньше отражается на содержании неорганического фосфора в крови, чем частичное, когда соотношение между фосфором, кальцием и магнием резко нарушается, что приводит к усиленному выведению фосфора из организма. Обеспеченность организма фосфором определяется не только абсолютным содержанием его в пище, но и его соотношением с другими компонентами пищи. Например, соотношение фосфора и белка в пище должно составлять по меньшей мере 1:40.
Суточной нормой фосфора для взрослого человека считают 1600 мг, потребность у беременных - 3000 мг, а у кормящих матерей 3800 мг в сутки (у детей она выше, чем у взрослых). Баланс Фосфора в организме зависит от общего состояния обмена веществ. Нарушение фосфорного обмена приводит к глубоким биохимическим изменениям, в первую очередь в энергетическом обмене.
Неорганические соединения фосфора, в первую очередь неорганический фосфат крови, играют существенную роль в поддержании кислотно-щелочного равновесия. Фосфор входит в состав важнейших органических фосфорилированных соединений организма: нуклеотидов, нуклеиновых кислот, фосфолипидов, фосфопротеидов, фосфорных эфиров углеводов, витаминов, коферментов и других соединений, участвующих в различных метаболических процессах и играющих ключевую роль в жизнедеятельности организма.
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих коферментов и других органических соединений. Благодаря особенностям химические строения атомы Фосфора, подобно атомам серы, способны к образованию богатых энергией связей в макроэргических соединениях: аденозинтрифосфорной кислоте (АТФ), креатинфосфате и других. В процессе биологической эволюции именно фосфорные соединения стали основными, универсальными хранителями генетической информации и переносчиками энергии во всех живых системах. Другая важная роль соединений Фосфора в организме заключается в том, что ферментативное присоединение фосфорильного остатка к различным органическим соединениям (фосфорилирование) служит как бы "пропуском" для их участия в обмене веществ, и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена фосфора - киназы, фосфорилазы и фосфатазы. Главную роль в превращениях соединений фосфора в организме человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
Фосфор (Р) - химический элемент с атомным номером 15. Его русскоязычное название в переводе с греческого означает "светоносный". Вместе с азотом входит в группу так называемых пниктогенов.
Фосфор является одним из самых распространенных химических элементов на Земле. Его содержание в земной коре составляет почти 0,1% от ее массы. В морской воде средняя концентрация фосфора составляет 0,07 мг/л.
Это очень химически активный элемент, поэтому в природе в свободном состоянии не встречается. Он входит в состав довольно большого количества минералов (около 200), самыми распространенными из которых являются апатит и фосфорит.
Фосфор был открыт в 1669 г. гамбургским алхимиком Хеннингом Брандом, который, как ему и было положено по статусу, искал философский камень, а получил необычное светящееся вещество. Кстати, предметом его химических манипуляций была человеческая моча, поскольку экспериментатор думал, будто ее желтый цвет обусловлен содержащимся в ней золотом. Таким образом, фосфор был открыт совершенно случайно. Причем было это так.
Бранд отстаивал мочу несколько дней, пока не исчезал неприятный запах. Затем он выпаривал ее до желеподобного состояния, получая своеобразную пасту. Далее он нагревал полученный ингредиент до высоких температур, пока не появлялись пузырьки. Через несколько часов таких кипячений получались крупицы белого, похожего на воск, вещества, которое легко воспламенялось и светилось в темноте. Кстати, со времен античности это было первое открытие химического элемента, хотя существует мнение, что арабы научились добывать чистый фосфор еще в XII веке. Несмотря на все эти открытия, только французскому химику Лавуазье удалось установить, что фосфор - это простое вещество, а не химическое соединение. В последующем естествоиспытатели открыли еще немало удивительных свойств этого экстравагантного элемента.
В частности, было установлено, что фосфор существует в нескольких аллотропических модификациях, некоторые из которых до сих пор не изучены. При определенных условиях фосфор становится самым настоящим металлом. Лучше всего исследованы такие модификации фосфора, как белый, красный, черный и металлический. Белый фосфор является самой неустойчивой модификацией и при нормальных условиях превращается в красный. Наиболее химически активен белый фосфор, наименее - черный. Красный фосфор по химической активности занимает между белым и черным промежуточное положение, Его мы знаем постольку, поскольку он легко воспламеняется при ударе или трении, поэтому широко используется в производстве самых обычных спичек (терочная поверхность спичечных коробков - "чиркаш").
Белый фосфор горит даже в воде, он очень ядовит (смертельная разовая доза для взрослого человека 0,05-0,15 г, то есть по токсичности он не уступает цианистому калию). При хроническом отравлении белым фосфором поражается костная ткань, что может привести, например, к омертвению челюстей. В руки его брать категорически нельзя, поскольку при соприкосновении с кожей он сразу же воспламеняется, оставляя очень сильные ожоги.
Роль фосфора в организме человека
Фосфор является органогеном, и в знакомых нам формах жизнь на Земле без него была бы невозможна. Это легко понять, если знать, что фосфор является составным элементом ДНК - основного носителя генетической информации о живых организмах. Без ДНК размножение известных форм жизни невозможно. Поэтому фосфор содержится во всех живых существах. В растениях он в той или концентрации присутствует почти везде, правда, в плодах и семенах его больше. Что касается животных, то там его также можно обнаружить во всех частях организма, но основная доля светоносного элемента концентрируется в костях.
Фосфор входит в состав многих белков и других важнейших органических соединений (уже упомянутая ДНК, главное "топливо" живой клетки - АТФ, а также фосфолипиды, ферменты, коферменты и т.д.). Основная часть фосфора в организме человека сконцентрирована в костях (как и у всех других позвоночных). В зубной эмали фосфор присутствует в составе фторапатита. Вот почему при нехватке фосфора в первую очередь развиваются заболевания костей и зубов.
Основной химической лабораторией по превращению соединений фосфора в организме человека является печень.
Суточная потребность в фосфоре у взрослого человека составляет 1-2 г. А вот молодому и растущему организму требуется поступление в сутки около 1,5-2,5 г фосфора, беременным женщинам и кормящим матерям и того больше - 3,0-3,8 г/сут. При интенсивных физических нагрузках потребность в фосфоре вырастает в 1,5-2 раза.
В организме взрослого человека содержится 500-750 г фосфора, причем 90% его сконцентрировано в зубах и костях.
Находясь в составе фосфолипидов и фосфопротеинов, фосфор играет важнейшую роль в построении клеточных мембран.
Фосфор входит в состав молекулы АТФ (аденозинтрифосфата), который необходим клеткам для преобразования белков, жиров и углеводов в энергию. Не случайно АТФ называют аккумулятором энергии. Кстати, ежедневно в организме человека синтезируется около 60 кг АТФ! Но это вовсе не означает, что наш организм всегда содержит такое огромное количество этого соединения. Дело в том, что АТФ постоянно (и очень быстро) превращается в АДФ (аденозиндифосфат), и наоборот.
В нервной системе человека фосфор также играет ключевую роль, поскольку его соединения принимают непосредственное участие в передаче нервного импульса..
Фосфор активирует очень многие ферменты нашего организма, а также витамин D и витамины группы В.
Он участвует в поддержании кислотно-щелочного баланса организма, улучшает усвоение глюкозы и многих других необходимых и полезных для организма веществ.
Таким образом значение фосфора для организма человека можно свести к следующему:
- обеспечение роста и восстановления организма;
- обеспечение энергетического обмена;
- входит в состав костей;
- без него невозможно существование ДНК - основного генетического строительного материала;
- координация кислотно-щелочного баланса;
- активация ферментных реакций;
- передача нервного импульса.
Источники фосфора для организма человека
Фосфор - легкоусвояемый элемент. Примерно 70% поступающего с пищей фосфора вовлекается в обмен веществ, причем фосфор, входящий в состав рыбы и морепродуктов, усваивается почти на 100%.
Наиболее богаты фосфором следующие продукты:
- молоко и кисломолочные продукты (особенно сыры) (до 550 мг%);
- мясо, птица, яйца, в особенности печень (380-500 мг%);
- фасоль и горох (300-500 мг%);
- рыба и черная икра (около 350 мг%);
- злаки (рожь, пшеница, овес), гречневая крупа (250-300 мг%);
- грецкие орехи и семечки;
- зелень и овощи (петрушка , шпинат , тыква, капуста , морковь , чеснок и др.) (100-150 мг%).
Лучше всего человеческим организмом фосфор усваивается при сочетании его соединений с веществами, содержащими кальций (оптимальное соотношение Р:Са - 3:2.
При употреблении продуктов из фосфора нужно знать меру, поскольку его избыток можно привести к довольно неприятным последствиям.
Недостаток фосфора в организме человека
Типичными причинами недостатка фосфора в организме человека являются:
- нарушения обмена веществ и связанные с ними заболевания, например, алкоголизм, сахарный диабет, дисфункция почечных канальцев, дисфункция щитовидной и околощитовидной желез;
- недостаточное поступление с пищей;
- повышенная потребность в силу высоких физических нагрузок, фазы роста организма, беременность и кормление грудью;
- голодание;
- избыточное поступление в организм соединений магния, алюминия, кальция и бария (ионы этих металлов образуют с фосфором нерастворимые соединения, поэтому выводят фосфор из обмена веществ);
- чрезмерное потребление газированных напитков (последствия сродни предыдущим);
- пищевые отравления;
Также установлено. что у тучных людей может развиться недостаток фосфора из-за того, что жировая ткань как бы отбирает соединения фосфора из соединительной ткани (костей), а также из внутренних органов (особенно страдает при этом печень и головной мозг). Именно по этой причине тучные люди страдают ожирением печени, апатией и сонливостью, легко впадают в депрессию, имеют нарушения в работе опорно-двигательного аппарата.
У детей-искусственников также может возникнуть нехватка фосфора.
Симптомы нехватки фосфора :
- истощение, отсутствие аппетита, слабость и ощущение разбитости;
- боли в мышцах, костях и суставах;
- ослабление иммунитета, в особенности к простудным заболеваниям;
- ожирение печени;
- дистрофические изменения миокарда;
- геморрагические высыпания на коже и поверхности слизистой;
- пародонтоз, рахит;
- психические заболевания.
Избыток фосфора
Сначала рассмотрим такую причину избытка фосфора, как отравление им, которое наиболее часто случается у лиц, вынужденных по профессии часто контактировать с ним.
Как уже было сказано, наиболее ядовит белый фосфор. При отравлении им наблюдаются следующие симптомы:
- жжение во рту и желудке;
- слабость;
- головная боль;
- рвота;
- желтуха (на 2-3 сутки).
При хроническом отравлении белым фосфором возникают:
- нарушение кальциевого обмена;
- поражение сердечно-сосудистой и нервной систем.
Красный фосфор почти безвреден, но при хроническом отравлении возможно развитие пневмонии.
Некоторые соединения фосфора настолько ядовиты, что используются как боевые отравляющие вещества (табун, зарин, зоман, V-газы).
Несмотря на это следует отметить, что фосфор в составе органических соединений, попадавющих в наш организм вместе с пищей. совершенно нетоксичен. Однако чрезмерное поступление в организм даже вполне безобидных соединений фосфора приводит к развитию ряда заболеваний.
Причинами избытка фосфора являются:
- несбалансированная диета с высоким содержанием белковых компонентов (т.н. "белковый перекорм");
- употребление большого количества консервированных продуктов, лимонадов;
- нарушения обмена веществ.
Еще совсем недавно дефицит фосфора в организме человека встречался намного чаще, чем его избыток. Однако широкое использование соединений фосфора в пищевой промышленности перевернуло эту статистику с "ног на голову": теперь медикам намного чаще приходится лечить избыток фосфора, чем его нехватку.
В пищевой промышленности чаще всего используются следующие соединения фосфора:
- ортофосфорная кислота (Е338);
- фосфат калия (Е340);
- фосфат кальция (Е341);
- фосфат аммония (Е342);
- фосфат магния (Е343).
Именно благодаря этим соединениям не слеживаются и не комкуются такие сыпучие продукты питания, как кофе, какао, сухое молоко и сухие сливки, не кристаллизуется сгущенное молоко, обеспечивается мягкая консистенция плавленных сыров (соли-плавители), увеличивается срок хранения молочных и мясных продуктов. Ими подкисляются безалкогольные напитки, повышается вес и объем колбас и копченостей.
Симптомами избытка фосфора могут быть:
- отложение солей;
- остеопороз;
- заболевания органов пищеварения, в особенности печени;
- понижение свертываемости крови, кровоизлияния;
- малокровие;
- лейкопения (снижение иммунитета).